Ответ
1. Эквимолярная смесь газообразных при нормальных условиях алканов X и Y имеет относительную плотность по алкану X — 0.682, а по алкану Y — 1.875.
Определите алканы.
В ответ запишите число атомов углерода в каждом из них.
Число атомов углерода в X: — 3
Число атомов углерода в Y: — 1
2. Установите соответствие между описанием углеводорода и общей формулой класса соединений, к которому этот углеводород относится.
Две π-связи и один цикл — CnH2n− 4
Два цикла — CnH2n−2
Два цикла и две π-связи — CnH2n−6
Три π-связи — CnH2n -4
CnH2n
CnH2n−2
CnH2n− 4
CnH2n−6
CnH2n−8
CnH2n−10
3. Неизвестное органическое соединение X массой 18.4 г сожгли в избытке кислорода. Образовавшуюся смесь газов привели к комнатной температуре, при этом образовалось 14.4 мл жидкости.
Оставшийся газ полностью растворился в 600 мл 1.5 М раствора гидроксида натрия, при этом образовался раствор двух солей с равными молярными концентрациями. Определите молекулярную формулу вещества X. В ответ запишите количество атомов углерода, водорода и кислорода (если данный атом отсутствует, запишите 0).
CxHxOx — С3Н803
4. Смесь хлорметана, хлорэтана и 2-хлорпропана обработали избытком натрия. Сколько различных алканов будет содержаться в полученной смеси? Протеканием побочных реакций нужно пренебречь.
Ответ:_6_
Определите наименьшую и наибольшую молярные массы среди всех алканов в полученной смеси. Ответы выразите в г/моль, округлите до целых.
Наименьшая молярная масса: _30__ г/моль
Наибольшая молярная масса: __86_ г/моль
5. Установите соответствие между алканом и количеством монохлорпроизводных, которые образуются при его хлорировании; учитывайте только структурные изомеры.
2,2,3-триметилбутан
2,3-диметилбутан
2,2-диметилпентан
2
3
4
5
6
2,2,3-триметилбутан — 4
2,3-диметилбутан — 3
2,2-диметилпентан — 5
6. Заполните пропуски в схемах реакций следующими веществами:
Cl2, KCl, FeCl3, FeCl2, Fe2O3, Fe3O4, FeO, 3Fe(NO3)3, O2, H2, H2O, Fe(NO3)2, K2FeO4, KOH.
K2FeO4 +HCl ⟶ __+ Cl2 + KCl +H2O
FeO + HNO3конц.⟶ __+ NO2 + H2O
__+ HNO3конц. ⟶ Fe(NO3)3 + H2O
__+ HCl ⟶ FeCl2 +FeCl3 + H2O
Fe(OH)2 +__⟶ FeO(OH) + H2O
2K2FeO4 + 16HCl = 3Cl2+ 2FeCl3 + 4KCl + 8H2O
FeO + 4HNO → Fe (NO) + NO + 2H O
Fe + HNO3 → Fe(NO3)3 + NO + H2O
FeCl2 + FeCl3 + H2O = Fe3O4 + HCl
4 Fe(OH) 2 + O 2 → 4 FeO(OH) + 2 H 2O
7. Полифосфаты натрия (NaPO3)n нашли широкое применение в качестве смягчающих воду реагентов. Их также используют для удержания влаги.
В лабораторию для анализа поступил образец полифосфата натрия количеством вещества 0.015 моль. Образец прокипятили в избытке раствора гидроксида натрия до полного гидролиза до ортофосфата натрия. Если образовавшийся раствор подкислить до слабокислой среды и добавить избыток нитрата серебра, то выпадает 37.71 г жёлтого осадка. Определите формулу полифосфата. В ответ запишите значение n.
8. Кусочек металла массой 14 г полностью растворили в 90 г соляной кислоты. Определите металл, если известно, что масса конечного раствора в 1.15 раз больше массы исходного раствора кислоты. В ответ запишите молярную массу металла, выразите в г/моль, округлите до целых.
Для решения данной задачи нам необходимо составить уравнение химической реакции. Так как металл растворили в соляной кислоте, то металл может быть растворен либо с образованием соли, либо с образованием воды, либо и с образованием соли и воды. Мы не знаем, какой именно металл растворили, поэтому мы не можем знать продукты реакции и составить уравнение.
Однако, мы можем узнать молярную массу неизвестного металла следующим образом:
- Найдем массу раствора после реакции:
m1 = mHCl + mMe = 90 + 14 = 104 г - Найдем массовую долю растворенного металла:
w = (mMe / m1) * 100% = (14 / 104) * 100 = 13,5% - Теперь найдем молярную массу:
M = 14 * 1000 / (100 — 13.5) = 29.4 г/моль.
Это молярная масса неизвестного металла. Она не соответствует ни одному известному металлу, однако, наиболее близка к магнию (Mg).
9. На чашах весов стоят растворы солей в одинаковых стаканах: на первой — 260 г 10 %-го раствора сульфата меди (II), на второй — 259 г раствора нитрата серебра.
- Хром
- Кадмий
- Цинк
- Железо
- Золото
Металлы, которые могли быть использованы для выравнивания чаш весов, включают цинк, алюминий, железо и медь. Все эти металлы могут реагировать с сульфатом меди, образуя осадки или растворимые комплексные соединения. В случае цинка и алюминия, реакция протекает с образованием малорастворимых оксидов и гидроксидов:
Zn + CuSO4 -> ZnSO4 + Cu
2Al + 3CuSO4 -> Al2(SO4)3 + 3Cu
В случае железа и меди, реакция проходит с образованием растворимых комплексов:
Fe + CuSO4 -> FeSO4 + CuSO3
Cu + CuSO4 -> 2CuSO3
В данном списке из перечисленных, у нас присутствует только цинк.
10. На рисунке представлен прибор для получения газа G.
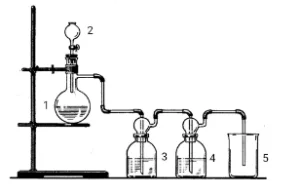
Для этого в круглодонную колбу помещается оксид марганца (IV), к которому медленно прикапывают концентрированную соляную кислоту.
Запишите формулу газа G.- Cl2
Промывные колбы 3 и 4 используются для очистки газа G. В колбу 3 обычно добавляют дистиллированную воду для поглощения хлороводорода. Какая жидкость подойдёт для колбы 4? Выберите все подходящие варианты:
Известковая вода
H2SO4(конц)
Аммиачная вода
CCl4
н-гексан
Бромная вода
Для колбы 4 подойдут: Известковая вода (для поглощения остатков хлора), Бромная вода (для окончательного окисления возможных следов хлора), H2SO4(концентрат) (для высушивания газа). Остальные варианты не подходят, так как они не предназначены для очистки хлора.
11. Благодаря способности серы к катенации (возможности образовывать цепочки из атомов одного и того же элемента) удалось выделить соли состава K2SnO6, которые называют политионатами.
При растворении навески некоторого политионата калия в растворе хлорной кислоты при 0 C∘ наблюдается выпадение белого осадка хлората калия. Если выпавший осадок отфильтровать, а фильтрат аккуратно нагреть, то выпадет 8 г жёлтого осадка и выделится 0.56 л (н.у) газа с резким запахом. При добавлении в образовавшийся раствор избытка хлорида бария наблюдается выпадение белого кристаллического осадка, нерастворимого в кислотах и щелочах.
Определите формулу политионата калия, в ответ запишите значение n.
Формула политионата калия имеет вид K2Sn(S)nO6, где n — число атомов серы в катене.
При нагревании политионата происходит разрыв катены и выделение серы:
K2Sn(S)nO6 → K2SnO6 + nS↓
Выпавший желтый осадок серы весит 8 г, значит в одной катене было n = 8 атомов серы.
Газ с резким запахом — это сера, которая выделилась при термическом разложении политионата. 1 моль серы занимает объем 22,4 л при н.у., значит суммарный объем выделившейся серы составляет 0,56 л, что соответствует 0,25 молям. Это означает, что в одной катене содержится 2 атома серы, то есть n=2.
Таким образом, формула политионата имеет вид K2Sn(S2)O6 или K4SnS4O6.
12. В органической химии получение какого‑либо сложного вещества чаще всего представляет собой многостадийный синтез. Каждая из стадий характеризуется выходом продукта.
Ниже представлена гипотетическая схема получения вещества A6 из A0. Определите выход реакции в последней стадии, если известно, что из A0 теоретически можно получить 5.000 г A6, но в результате было получено только 1.037 г. Ответ выразите в процентах, округлите до целых.
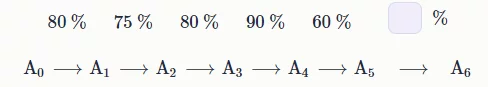
Ответ: 21%
